上海科技大学常任副教授王皞鹏团队联合中国科学院分子细胞科学卓越创新中心研究员许琛琦、美国匹兹堡大学医学院教授达里奥·维尼亚利、北京大学肿瘤医院教授孔燕以及百济神州沈志荣,首次阐明了免疫检查点LAG3受体激活的分子开关机制,并开发了基于功能性生物标志物的疗效预测体系,为靶向免疫检查点的精准治疗提供了新策略。3月17日,相关研究发表于《细胞》。
免疫检查点是T细胞表面的抑制性受体,肿瘤可通过激活这些受体抑制T细胞功能,从而实现免疫逃逸。免疫检查点抑制剂可解除这种抑制作用,激活机体的抗肿瘤免疫响应。然而,LAG3免疫疗法的临床响应率仍不高,如何精准筛选可能获益的患者群体成为当前急需突破的临床瓶颈。
研究团队对LAG3蛋白的翻译后修饰(PTM)进行了系统分析,发现LAG3受体结合配体后,其K498位点发生快速多泛素化修饰。这一泛素化修饰是开启LAG3免疫抑制功能的分子开关:在静息状态时,LAG3的胞内关键信号域被埋藏在细胞膜中,隔离信号转导;当配体与LAG3受体结合后,泛素化修饰可促使LAG3胞内信号域从细胞膜中释放出来,有效激活LAG3的免疫检查点功能。这种由泛素化介导的“埋藏-释放”动态调控机制,揭示了一种全新的受体活化方式。
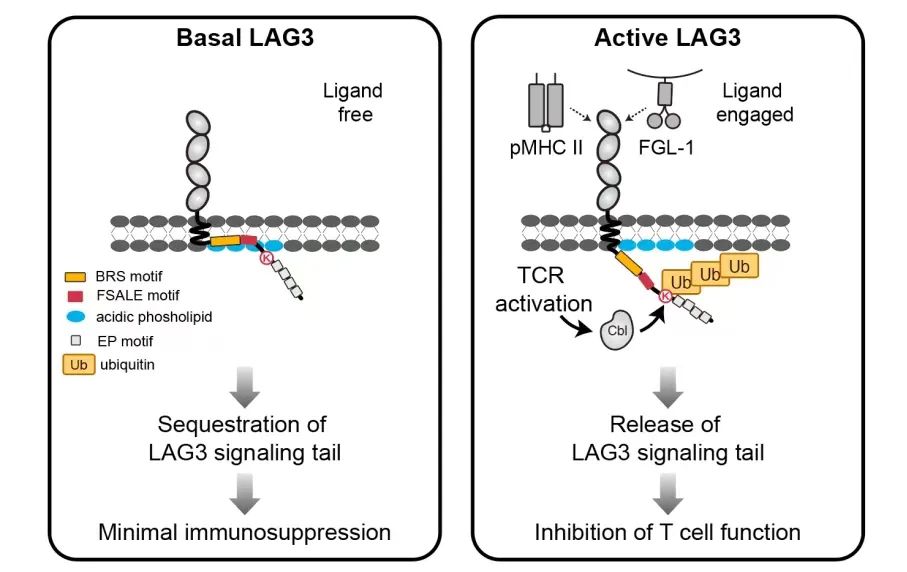
免疫检查点LAG3受体的激活机制示意图。图片由研究团队提供
进一步地,研究团队开发出一种新型的疗效预测生物标志物。临床研究中,该标志物能够准确区分治疗获益人群,其表达水平在获益组较非获益组升高51.7倍,而传统表达生物标志物仅显示出6.5倍的差异且无统计学意义。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国