在统计力学中,吉布士熵(英语:Gibbs entropy)是平衡态热力学平衡下体系熵的通用表达式。
简介在统计力学中,吉布士熵(英语:Gibbs entropy)是平衡态热力学平衡下体系熵的通用表达式。如果体系有n个能级,占第i个能级的机率是 ,体系的熵就是
,体系的熵就是
 其中
其中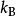 是波兹曼常数,这条公式叫吉布士熵公式。1
是波兹曼常数,这条公式叫吉布士熵公式。1
统计力学统计力学(Statistical mechanics)是一个以玻尔兹曼等人提出以最大熵度理论为基础,借由配分函数将有大量组成成分(通常为分子)系统中微观物理状态(例如:动能、势能)与宏观物理量统计规律 (例如:压力、体积、温度、热力学函数、状态方程等)连结起来的科学。如气体分子系统中的压力、体积、温度。伊辛模型中磁性物质系统的总磁矩、相变温度、和相变指数。
通常可分为平衡态统计力学,与非平衡态统计力学。其中以平衡态统计力学的成果较为完整,而非平衡态统计力学至今也在发展中。统计物理其中有许多理论影响着其他的学门,如信息论中的信息熵。化学中的化学反应、耗散结构。和发展中的经济物理学这些学门当中都可看出统计力学研究线性与非线性等复杂系统中的成果。1
热力学平衡热力学平衡,简称热平衡,指一个热力学系统在没有外界影响的条件下,系统各部分的宏观属性(如物质的量、能量、体积等)在长时间内不发生任何变化的状态。
热平衡是热力学中的一个基本实验定律,其重要意义在于它是科学定义温度概念的基础,是用温度计测量温度的依据。
在热力学中,温度、内能、熵是三个基本的状态函数:
内能是由热力学第一定律确定的;
熵是由热力学第二定律确定的;
温度是由热平衡定律确定的。
所以热平衡定律如第一、第二定律一样也是热力学中的基本实验定律,其重要性不亚于热力学第一、第二定律,但由于人们是在充分认识了热力学第一、第二定律之后才看出此定律的重要性,故英国著名物理学家拉尔夫·福勒称它为热力学第零定律。1
熵化学及热力学中所谓熵(英语:entropy),是一种测量在动力学方面不能做功的能量总数,也就是当总体的熵增加,其做功能力也下降,熵的量度正是能量退化的指标。熵亦被用于计算一个系统中的失序现象,也就是计算该系统混乱的程度。熵是一个描述系统状态的函数,但是经常用熵的参考值和变化量进行分析比较,它在控制论、概率论、数论、天体物理、生命科学等领域都有重要应用,在不同的学科中也有引申出的更为具体的定义,是各领域十分重要的参量。1
相关条目波兹曼常数
焓
熵
混合熵
熵 (信息论)
信息论
热力学自由能
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国